A kioldódás alapjai
A kioldódási vizsgálat arra ad választ, hogy egy szilárd gyógyszerforma milyen sebességgel és milyen mértékben oldódik ki egy meghatározott, szabványosított közegben.
Mi az a kioldódás vizsgálat?
A kioldódás vizsgálat azt méri, hogy egy szilárd gyógyszerforma – jellemzően tabletta vagy kapszula – hatóanyaga milyen sebességgel és milyen mértékben oldódik ki egy meghatározott, szabványosított közegben.
A vizsgálat során nem a gyógyszer „hatását” mérjük, hanem egy kontrollált laboratóriumi környezetben lezajló fizikai–kémiai folyamatot, amelynek célja az, hogy információt adjon a készítmény viselkedéséről.
A USP és az Europen Pharmacopoeia egyaránt alapvető minőségi vizsgálatként határozza meg a kioldódás vizsgálatot számos szilárd gyógyszerforma esetében.
Fontos hangsúlyozni:
a kioldódás vizsgálat nem in vivo mérés, de nem is pusztán elméleti kísérlet. Egyfajta híd a gyógyszer fizikai tulajdonságai és a biológiai viselkedés között.
Mit mond meg valójában a kioldódás?
A kioldódás vizsgálat arra ad választ, hogy:
- milyen gyorsan válik a hatóanyag oldott formában hozzáférhetővé,
- mennyire reprodukálható ez a folyamat,
- és hogyan reagál a rendszer kisebb változtatásokra.
Ez nem pusztán fizikai kérdés.
A kioldódás a biohasznosulás egyik legfontosabb előszobája: a hatóanyag csak akkor tud felszívódni, ha előbb oldott állapotba kerül. Bár a két fogalom nem azonos, a kioldódás minősége erősen befolyásolja a későbbi biológiai lépéseket.
Ezért vált a kioldódás vizsgálat kulcsfontosságú eszközzé mind a fejlesztés, mind a minőségellenőrzés során.
Miért kritikus a kioldódás vizsgálat?
A kioldódás vizsgálat különleges helyet foglal el a gyógyszervizsgálatok között, mert rendkívül érzékeny.
Előrejelzés
Megfelelően megválasztott módszer esetén segít előre jelezni, hogy egy készítmény hogyan viselkedhet a szervezetben. Nem helyettesíti az in vivo vizsgálatokat, de fontos kockázatcsökkentő eszköz.
Gyártási változások indikátora
A kioldódás vizsgálat gyakran az első módszer, amely „jelzi”, ha:
- a granulálás megváltozott,
- az összenyomási erő eltért,
- a segédanyag minősége módosult.
Sok esetben a kioldódás már akkor eltérést mutat, amikor más paraméterek még specifikáción belül vannak.
Stabilitási problémák korai jelzője
A kioldódási profil érzékenyen reagálhat:
- nedvességfelvételre,
- kristályszerkezeti változásokra,
- bevonatok öregedésére.
Ezért stabilitási vizsgálatok során a kioldódás gyakran korábbi figyelmeztető jel, mint a hatóanyagtartalom.
Szabályozói elvárás
Számos készítmény esetén a kioldódás vizsgálat kötelező, és a módszer validációja, robusztussága és dokumentáltsága kiemelt hatósági elvárás. A vizsgálat nem „ajánlott”, hanem szabályozott minőségi kritérium.
Hol használják a kioldódás vizsgálatot?
A kioldódás vizsgálat nem egyetlen élethelyzethez kötődik, hanem végigkíséri a gyógyszer életciklusát.
Fejlesztés (R&D)
Formulálás során segít összehasonlítani receptúrákat, optimalizálni segédanyagokat és kiválasztani a megfelelő technológiát.
Technológia-transzfer
A kioldódási profil gyakran az egyik legfontosabb „összehasonlító ujjlenyomat”, amikor egy gyártási hely vagy technológia változik.
Rutin minőségellenőrzés (QC)
Gyártási tételek felszabadításakor biztosítja, hogy a készítmény a specifikációnak megfelelően viselkedik.
Stabilitási vizsgálatok
Hosszú távon követi, hogy a készítmény megőrzi-e eredeti tulajdonságait a teljes eltarthatósági idő alatt.
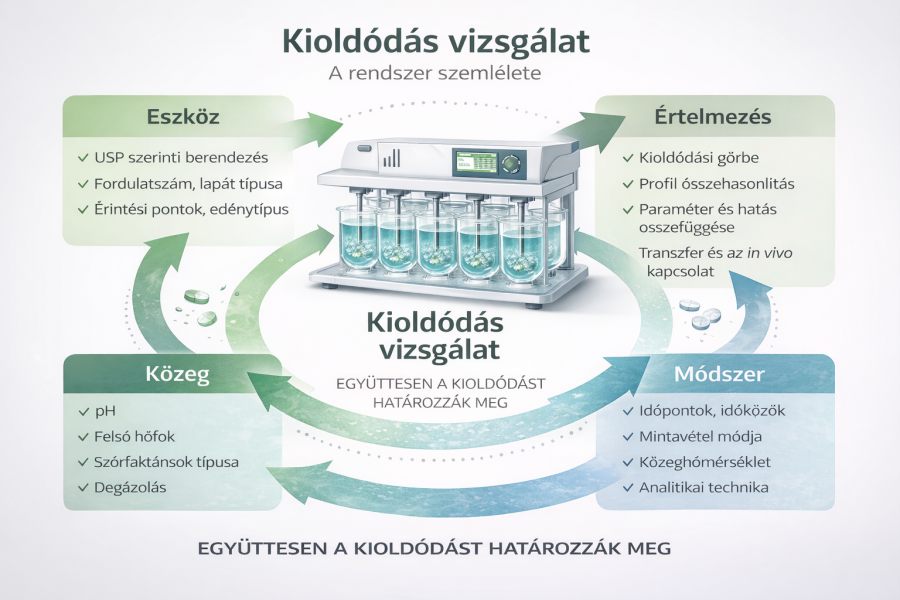
Fontos szemléleti alapelv
A kioldódás vizsgálat nem egyetlen mérés és nem egyetlen szám.
Ez egy teljes rendszer, amelyben:
- az eszköz,
- a kioldóközeg,
- a módszer paraméterei,
- és az eredmények értelmezése
elválaszthatatlanul összetartoznak.
Ha bármelyik elem nincs megfelelően kontrollálva, a mérés formálisan helyes lehet – mégis félrevezető eredményt adhat. A kioldódás vizsgálat megértése ezért nemcsak technikai tudást, hanem rendszerszintű gondolkodást igényel.
Hivatkozások és további olvasmány
Szabályozói és gyógyszerkönyvi források
- United States Pharmacopeia – Dissolution (általános áttekintés)
- USP <711> Dissolution – általános fejezet
- USP <1092> The Dissolution Procedure: Development and Validation
- European Pharmacopoeia – Dissolution testing (általános információk)
Elméleti és szemléleti háttér
- Dressman et al. – Dissolution testing as a prognostic tool for oral drug absorption
- Developing a quality by design approach to model tablet dissolution testing: an industrial case study